1Heidelbergi Egyetem, Szívsebészet, Németország, Semmelweis Egyetem, Kardiológiai Központ
2Heidelbergi Egyetem, Szívsebészet, Németország
3II. Patológiai Intézet, Budapest
4Semmelweis Egyetem, Kardiológiai Központ
5Semmelweis Egyetem, Kardiológiai Központ
6Heidelbergi Egyetem, Szívsebészet, Németország, Semmelweis Egyetem, Kardiológiai Központ
7Semmelweis Egyetem, Kardiológiai Központ
8Heidelbergi Egyetem, Szívsebészet, Németország
9Heidelbergi Egyetem, Szívsebészet, Németország
Szövetépítés egész szíven
2011-12-14A szívet fókuszába állító szövetépítő kutatómunka (cardiac tissue engineering) során alkalmazott háromdimenziós vázszerkezetek kialakításáról és felhasználási lehetőségeiről szóló tudományos publikációk száma nem jelentős. A szívbillentyűktől és az erektől eltérően a szívizomzat implantátummal történő pótlására nincs alternatív lehetőség. Ugyanakkor a myocardium funkcióvesztésével járó végstádiumú szívelégtelenség napjainkban egyetlen terápiás lehetőségét, a szívtranszplantációt korlátozza a rendelkezésre álló donorszívek mennyisége. Emellett sikeres szívátültetésen átesett betegek a kilökődést gátló gyógyszerek következtében számos súlyos mellékhatástól szenvedhetnek.
Ezeknek a problémáknak egyik megoldása lehet a jövőben szövetépítés, amellyel olyan élő szövet hozható létre, ami képes az átépülésre, megújulásra és növekedésre. Az őssejt-izolálás, a sejtkultúrák fenntartása és a bioaktív anyagok szintézise területén létrejött fejlődés megteremtette az ex vivo felépített egész szív létrehozásának lehetőségét. Az egész szív decellularizációjával létrehozott architektúra megfelelő vázat biztosíthat háromdimenziós, emberi méretű élő szövetek képzéséhez acelluláris mátrixból.
Összefoglalónkban áttekintjük az egész szíves szövetépítés kérdéskörének lényeges pontjait; kiemelve a sejtek megtapadásának alapjául szolgáló háromdimenziós váz jelentőségét, amelyre képesek a sejtek ránőni – akár in vitro, akár in vivo –, illetve a remodelláció útján megteremtik egy működőképes szív kialakulásának lehetőségét.
Világszerte évente több ezer kiterjedt szívinfarktuson átesett betegnél alakul ki súlyos szívelégtelenség. A progresszív betegség kezelése és megelőzése a ma ismert legmodernebb technikák alkalmazása ellenére sem megoldott (1). A kialakult krónikus megbetegedés hatalmas terhet ró mind a betegekre és családjaikra, mind a társadalomra. A végstádiumú szívelégtelenség egyetlen igazi megoldása a szívátültetés, ez azonban a csökkenő donorszám miatt nem tudja kielégíteni az igényeket.
Az emberi szív regenerációs képessége korlátozott, hiszen az érett szívizomsejtek nem képesek osztódni, ezért a szívizmot ért károsodások jobbára visszafordíthatatlanok. A mesterségesen előállított szívizomszövet alternatívát kínálhat a károsodott szívizom pótlására.
A kialakult balkamra-funkció elégtelensége esetében terápiás lehetőség az LVAD (left ventricular assist device, bal kamrai keringéstámogató eszköz) beültetése, ez azonban általában nem jelent végleges megoldást, hanem csupán áthidaló kezelést a transzplantációig (9): 859–867.">(2). Mindezek ismeretében felmerül az igény egy olyan terápiás lehetőség iránt, amely képes visszafordítani ezt a gyakori, progresszív kórképet. Egy ígéretes megoldás lehet a jövőben a szívstruktúrákra fókuszáló szövetépítés.
A myocardium súlyosan károsodott vagy már elhalt sejtjeinek helyettesítése mind az orvosoknak, mind a betegeknek egy új terápiás lehetőséget jelent; ez képezi az egész szíves szövetépítés mozgatórugóját. Az elégtelen szervműködés kialakulásától kezdve adott a lehetőség, hogy egy részleges vagy egész szerv integrálható legyen a súlyosan heges myocardiumhoz vagy transzplantáció során teljesen átvehesse a szívműködést (3).
A szövetépítés klasszikus paradigmái
Számos kísérlet történt szövetalapú szívizomgraftok létrehozására, azonban minden modell esetében érvényes két alapvető feltétel. Egyrészt, szükség van egy háromdimenziós támasztószövetre vagy vázra, amely kielégíti az alábbi kritériumokat:
- megfelelő mechanikai és biológiai integritása van,
- dinamikus és biokémiai jelátvitelre képes,
- sejtkapcsolatok és migráció alakulhat ki benne,
- biztosítja a létfontosságú tápanyagok és faktorok diffúzióját, valamint
- teret biztosít a vázszerkezet dinamikus változásainak.
Az ilyen vázakat eredetük alapján két csoportba oszthatjuk: szintetikus és biológiai vázak (4). Másrészt szükség van egy celluláris komponensre, amelynek előállítására két módszer lehetséges: vagy autológ eredetûek és in vitro úton nyerhetők ki, vagy dinamikus, kémiailag stimulált környezetből állíthatók elő. Az előállítás lényege, hogy a létrehozott bioanyag képes legyen molekuláris szinten, pontos és szabályozott módon kommunikálni a sejtekkel, hasonlóképpen a sejtek és az extracelluláris mátrix (ECM) között található fiziológiás interakciókhoz.
Következésképpen az elmúlt években a kutatások olyan bioaktív anyagok kifejlesztésére irányultak, amelyek rendelkeznek egyrészről a szintetikus polimerek szilárdságával és degradációs kinetikájával, másrészről az extracelluláris mátrix összetevőinek – kollagén, fibronektin, laminin – biológiai specificitásával.
Az épített szöveti struktúrával szemben követelmény, hogy
- kontraktilis,
- elektrofiziológiailag stabil,
- mechanikailag szilárd ugyanakkor flexibilis,
- vaszkularizált vagy gyors vaszkularizálódási potenciállal bíró legyen. Emellett
- ne legyen immunogén (9): 1639–1647.">(5).
Ilyen ideális szerkezet ma még nem létezik. A közelmúlt kutatásai azonban már létrehoztak olyan szerkezeteket, amelyek kielégítik ezeknek az ambiciózus kritériumoknak egy részét.
A decellularizációs kezelés rövid összefoglalása
Számos decellularizációs protokoll került kifejlesztésre, amelyek lényegesen eltérnek egymástól a kezelés során kapott acellularitás mértéke, az előállított ECM-váz antigenitása, valamint a folyamat által okozott, extracelluláris mátrixot ért károsodás tekintetében (6, 7, 8). A legtöbb szövettípus teljes decellularizációjához az adott szövettípusra specializált fizikai, enzimatikus és kémiai kezelés szükséges. Általánosságban elmondható, hogy az acelluláris mátrix kinyeréséhez elégséges legenyhébb protokollt kell alkalmazni, amellyel így elkerülhető az extracelluláris mátrix funkcionális és strukturális komponenseinek sérülése.
A leggyakrabban alkalmazott decellularizációs ágenseket 4 csoportba oszthatjuk:
- nem-ionos detergensek (pl. Triton X 100) (9, 10, 11),
- ionos detergensek (pl. SDS) (9, 10, 12, 13), dezoxikolsav/DOA (12, 14, 15, 16),
- enzimek (pl. tripszin) (10, 17, 18), RNázok, Dnázok (19, 20),
- keláló anyagok (pl. EDTA) (21, 22).
A legtöbb esetben a fent említett decellularizációs kezelések és kombinációik kerülnek alkalmazásra. Az SDS (12, 14), valamint az ionos és nem-ionos detergenseket kombináló protokollok (14) kiváló decellularizáló képességet mutattak, ugyanakkor megőrizték az extracelluláris mátrix molekuláris szerkezetét. Kimutatták továbbá, hogy az SDS-kezelés a kollagénrostok szétválását (14), valamint a kollagén fragmentációját és duzzadását (23) váltotta ki. Egyéb faktorok is befolyásolhatják az extracelluláris mátrix megtartásának mértékét:
- a detergens koncentrációja,
- a kezelés időtartama,
- különböző proteáz-inhibitorok jelenléte, valamint
- a fajok közötti különbségek (11).
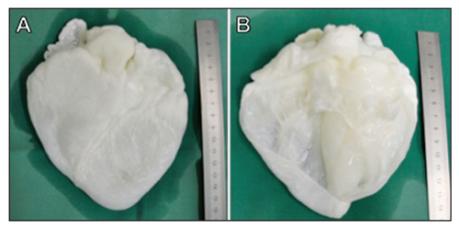
Kutatócsoportunk kifejlesztett egy perfúzión alapuló technikát, amely a gyakran használt detergens, az SDS alkalmazására épül (24). Vizsgálataink során az általunk SDS-sel létrehozott biológiai mátrix nem tartalmazott látható sejtes elemeket (1. ábra).
Egyértelmű, hogy a fizikai, enzimatikus és kémiai kezelések jelentős hatással bírhatnak a természetes szövetek és szervek decellularizációjával létrehozott biológiai vázak összetételére és mechanikai tulajdonságaira, valamint a host által tanúsított válaszreakcióra, amelynek következtében szerepük nem elhanyagolható az ezt követő in vitro és in vivo alkalmazások során.
Az adhéziós fehérjék és glükózamino-glikánok eltávolítása a biológiai vázból lelassíthatja a sejtek vázra való migrációját, valamint magának a váznak a bioaktivitását.
A kollagénhálózat megbomlása megváltoztatja a váz mechanikai viselkedését és a kollagénrostok kinetikáját, ezáltal befolyásolja a váz terheléstûrő kapacitását, illetve megváltoztatja a sejtek mechanikai környezetét is. Emellett a kollagén lebomlása is jelentősen befolyásolja a váz bioaktivitását és mechanikai jellemzőit. Az alkalmazott kémiai kezelések tovább gyengíthetik az ECM-vázat úgy, hogy csökkentik az in vivo enzimatikus bontással szembeni ellenálló képességét, így felgyorsítják a váz tartóerejének csökkenését.
Valószínűtlen, hogy létezik olyan módszer, amely száz százalékban eltávolítja az adott szövet vagy szerv sejtes összetevőit. Úgy tűnik azonban, hogy azok a technikák, amelyek a látható sejtes elemek nagy részét vagy összességét eltávolítják, biztonsággal beültethető biológiai vázat hoznak létre (25).
Bioartificiális szív a kardiális szövetépítés jövője?
Egészen a közelmúltig az „egész szív” mesterséges létrehozása kivitelezhetetlen feladat volt. Sőt, bármely működő, komplex, vaszkularizált, háromdimenziós szövet vagy szerv létrehozását megoldhatatlan feladatnak tekintették a szövetépítés terén, ugyanis a szervek ultrastruktúrájának in vitro reprodukálása – illetve még csupán a minimális komplexitással rendelkező szövetek fenntartásához szükséges elegendő bonyolultságú érhálózat létrehozása – túlságosan nehéz feladatnak bizonyult. Egy teljes mértékben szintetikus szív létrehozása speciális kihívást jelent, lévén a myocardium egy kontraktilis szövet, különleges strukturális és energetikai jellemzőkkel. Ilyen például a szívizom és a billentyűk kapcsolata, amely biztosítja a vér ki- és beáramlását a szív üregeiből – ehhez azonban elengedhetetlen a speciális térbeli elhelyezkedés, illetve a sejtek és a mátrix közötti elektromos és mechanikus kapcsolat. Szintén nem elhanyagolható a szívizomszövet hypoxia iránti fokozott érzékenysége, amelynek következtében a szívizomsejtek sűrű érhálózatot igényelnek a túléléshez és a megfelelő kontraktilis aktivitáshoz. Végül, a szívizomszövet tartalmaz őssejteket és progenitor sejteket is, amelyek képesek érett szívizomsejtek kialakítására (pl. pitvarok, kamrák vagy nodális szövet), így a szívizomszövet teljes értékű pótlására különösen nehéz alkalmas alapanyagot találni.
Ez utóbbi funkciót támasztja alá az a vizsgálat, amelyben decellularizált vázba neonatális szív eredetű sejteket injektáltak, majd folyamatos elektromos ingerlés és mechanikus töltés alatt egy bioreaktorban növesztették. A kísérlet során, 8-10 nap múlva a recellularizált bal kamrai szegmentumok kontrakcióit lehetett regisztrálni, illetve gyógyszerkészítményekkel válaszreakciót lehetett kiváltani (9). Egy szövetépítéssel létrehozott szív a jövőben akár használható lehet gyógyszerként alkalmazni kívánt hatóanyagok kardiotoxicitásának tesztelésére is (26).
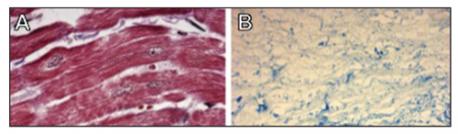
Kutatócsoportunk korábbi publikációjában szerepelnek klinikai megfigyelések az in vivo szövetépítéssel decellularizált xenograft mátrixokon létrehozott pulmonalis billentyűkről (27). Jelenlegi célunk egy olyan, sorozatgyártásra alkalmas háromdimenziós miokardiális váz létrehozása, amelyet az implantációt megelőzően lehetséges bevonni élő sejtekkel. A természet már eleve létrehozott egy teljes, vaszkularizált vázat, amely a szív szerkezeti alapját képezi, így kutatásunk kiindulópontjának ezt a már meglévő vázat választottuk. Feltételeztük, hogy a celluláris komponensek myocardiumból történő eltávolításával egy olyan háromdimenziós, natív szív eredetű ECM-ből álló vázat kapunk, amely rendelkezik az eredeti négyüregű elrendezéssel és a natív szív felépítésével. Az 1. ábra mutatja négyüregű decellularizált szívet: az acelluláris mátrix megtartotta a szív finom szerkezetét és makroszkópos geometriáját. A preparálás során disznószíven, detergens alapú perfúziós decellularizáiós technikát alkalmazva a celluláris komponensek teljes mértékben eltávolíthatóak voltak, míg a váz megőrizte a natív szív strukturális és biokémiai jellemzőit (1. ábra). Amint az 1. ábrán is látható, a szívizom falszerkezete, a billentyűk, a papilláris izmok és a trabekulák mind megfigyelhetők a sejtek eltávolítása után is. Nem volt kimutatható adhézió, szerkezetromlás és a vitorlák megvastagodása sem. A billentyűk a további vizsgálatok során sima, egyenletes felszínt mutattak, fényáteresztő, decellularizált vitorlákkal, amelyeken fenesztráció vagy duzzanat nem volt tapasztalható (3. ábra).
Az általunk végzett kísérletek során felhasznált disznószívek vágóhídi állatokból származtak; az előkészítés során a szíveket perfúziós technikával decellularizáltuk, így csökkentettük a graftok antigenitását. A későbbiekben a disznószív, mint a biológiai váz potenciális forrása, számos előnnyel rendelkezhet:
- könnyen és nagy mennyiségben beszerezhető,
- megfelelő méretű humán transzplantációra,
- a humán és disznószívek anatómiailag jelentős hasonlóságot mutatnak,
- a disznószövet felszíne erős celluláris adhéziós potenciállal bír (28), és
- rendelkezik – a szintetikus polimerekkel ellentétben – egy vaszkularizált, bazális membránnal bíró, háromdimenziós, ECM-proteineket (pl. kollagént, elasztint, proteoglikánokat) tartalmazó tartómátrixszal, amely lehetővé teszi az élő sejtek migrációját.
Összességükben ezek az ECM-fehérjék kritikus elemei a szövetépítéssel létrehozott szerkezeti vázaknak mind a strukturális integritás, mind a biomechanikai tulajdonságok megtartásának szempontjából (29).
A bemutatott eredmények jól demonstrálják az egész szíves szövetépítés területén az elmúlt évek során lezajlott fejlődést. Az acelluláris állapot eléréséhez minimálisan szükséges SDS-koncentrációt alkalmazva az extracelluláris mátrix kimutathatóan megtartja fiziológiás morfológiáját, amely így képes a beültetett sejtek differenciálódásához és működéséhez szükséges biokémiai szignálok biztosítására (30, 31).
Ezek az eredmények együttesen alátámasztják a perfúziós módszerrel decellularizált egész disznószívek, mint potenciális vázak lehetőségét a miokardiális szövetépítés terén.
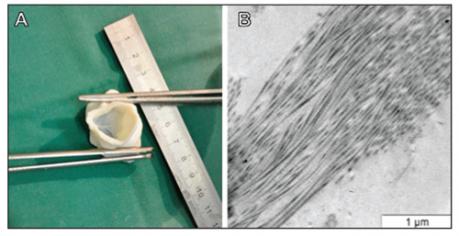
Korábban számos próbálkozás történt egyszerűbb szívszövetek, mint például acelluláris vagy egyszerűbb sejtalapú szövetelemek szövetépítéssel történő megalkotására. Azonban a szívizomsejtek magas oxigenizációs és energetikai igényeinek következtében már néhány száz mikronnyi vastagságú szövet is túl vastagnak bizonyult a túlélésre (32, 33). Ezt elkerülendő, egyesek csatornázott szintetikus ECM-et kombináltak oxigénhordozókkal, mások egy sejtrétegből álló szívizomszövet-lemezeket helyeztek egymásra (34–36). Ezek a próbálkozások megerősítették azt a feltételezést, hogy a perfúzió mértéke közvetlen összefüggésben áll a graft vastagságával és a sejtsűrűséggel (33, 37). Mindezek csupán apró előrelépések a végső cél, a humán szívben találhatóhoz hasonló falvastagságú szívizomgraft létrehozásához, amely nem jöhet létre a szövettel egyidejűleg létrehozott érhálózat hiányában. Több kísérlet történt a szövetépítéssel előállított szívizomszövetekben egy érhálózat kiépítésére is (endothelsejteknek a szívizomsejteket tartalmazó lemezek közé történő rétegezése, angiogenezist serkentő növekedései faktorok alkalmazása, speciális mikropórusok létrehozása) (38), ezek közül azonban egy se jelentett definitív megoldást. A szív eredetű ECM tartalmazza a szív működéséhez elengedhetetlenül szükséges perfúziót biztosító komplex érhálózatot, ezért kutatócsoportunk kifejlesztette azt a perfúziós technikát, amelynek segítségével eltávolíthatóak a cadaver szövetből a sejtes elemek, azonban az ECM-be ágyazva megőrizhető az acelluláris vaszkuláris hálózat (2. ábra), amire a későbbiekben funkcióképes neonatális cardiomyocyták ültethetők. Ha ezek alapján a szív ECM teljes vastagságában sikerül újjáteremteni az érhálózatot, azzal megalapozható a komplex szív-struktúrák megszerkesztésének lehetősége.
Következtetések
Bár az egész szíves szövetépítés tudománya még a kezdeteknél tart, a bioarteficiális úton létrehozott szervek számos problémára kínálhatnak megoldást – többek között a fejlődésbiológia, a kórélettan és a sejtterápia kutatási területein. Összefoglalónkban bemutattuk, hogy a perfúziós technika a natív szívizomban található transzportviszonyokhoz hasonló feltételeket teremt, így lehetővé teszi egységes szöveti szerkezetű, háromdimenziós acelluláris szerkezetek in vitro létrehozását.
Az disznószívek SDS-perfúziós decellularizációjával olyan váz nyerhető, amely a további kutatások során az egész szíves szövetépítés alapját képezheti. Az általunk elért eredmények megteremtik egy olyan szívizomszövet felépítésének lehetőségét, amely egyaránt rendelkezik kontraktilis képességgel, képes reagálni gyógyszerekre, továbbá képes az utóterheléssel szembeni folyadéktovábbításra.
Az általunk kifejlesztett perfúziós decellularizációs technika segítségével olyan háromdimenziós xenograft vázat tudunk létrehozni, amely egyben acelluláris és recellularizálható (10). Az SDS-sel végzett sejteltávolítás technikailag egyszerű, mégis csaknem totális acellularitást eredményez, ugyanakkor nem befolyásolja jelentősen az extracelluláris mátrix morfológiáját. Kutatómunkánk további célja kideríteni, hogy – amint ezt már kisebb modelleken kimutatták (9) – ezek a háromdimenziós vázak alkalmasak lehetnek-e erőkifejtésre és ingervezetésre képes élő, kontraktilis sejteket tartalmazó, intakt szívizomszövet fenntartására.
Támogatás
Jelen munka a Land Baden-Württenberg és a TÁMOP 4.2.2-08/1/KMR-2008-0004 támogatásával készült.
2. Copeland JG, Smith RG, Arabia FA, et al. Cardiac replacement with a total artificial heart as a bridge to transplantation. N Engl J Med 2004; 351 (9): 859–867.
3. Taylor DA, Robertson MJ. The basics of cell therapy to treat cardiovascular disease: one cell does not fit all. Rev Esp Cardiol 2009; 62: 1032–1044.
4. Dohmen PM, Konertz W. Tissue-engineered heart valve scaffolds. Ann Thorac Cardiovasc Surg 2009; 15 (6): 362–367.
5. Zimmermann WH, Melnychenko I, Eschenhagen T. Engineered heart tissue for regeneration of diseased hearts. Biomaterials 2004; 25 (9): 1639–1647.
6. Akhyari P, Aubin H, Gwanmesia P, et al. The quest for an optimized protocol for whole-heart decellularization: a comparison of three popular and a novel decellularization technique and their diverse effects on crucial extracellular matrix qualities. Tissue Eng Part C Methods 2011; 17 (9): 915–926.
7. Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials 2011; 32 (12): 3233–3243.
8. Badylak SF, Taylor D, Uygun K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds. Annu Rev Biomed Eng 2011; 13: 27–53.
9. Ott HC, Matthiesen TS, Goh SK, et al. Perfusion-decellularized matrix: using nature´s platform to engineer a bioartificial heart. Nat Med 2008; 14: 213–221.
10. Wainwright JM, Czajka CA, Patel UB, et al. Preparation of cardiac extracellular matrix from an intact porcine heart. Tissue Eng Part C Methods 2010; 16 (3): 525–532.
11. Grauss RW, Hazekamp MG, Oppenhuizen F, et al. Histological evaluation of decellularized porcine aortic valves: matrix changes due to different dezellularization methods. Eur J Cardiothorac Surg 2005; 27: 566–571.
12. Booth C, Korossis SA, Wilcox HE, et al. Tissue Engineering of cardiac valve prostheses I: development and histological characterization of an acellular porcine scaffold. J Heart Valve Dis 2002; 11: 457–462.
13. Grauss RW, Hazekamp MG, van Vliet S, et al. Decellularization of rat aortic valve allografts reduces leaflet destruction and extracellular matrix remodelling. J Thorac Cardiovasc Surg 2003; 126: 2003–2010.
14. Kasimir MT, Rieder E, Seebacher G, et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs 2003; 26: 421–427.
15. Erdbrügger W, Konertz W, Dohmen PM, et al. Decellularized xenogenic heart valves reveal remodeling and growth potential in vivo. Tissue Eng 2006; 12: 2059–2068.
16. Dohmen PM, Costa F, Lopes SV, et al. Results of a decellularized porcine heart valve implanted into the juvenile sheep model. Heart Surg Forum 2005; 8 (2): E100–4.
17. Cebotari S, Mertsching H, Kallenbach K, et al. Construction of autologous human heart valves based on an acellular allograft matrix. Circulation 2002; 106 (Suppl I): 163–118.
18. Steinhoff G, Stock U, Karim N, et al. Tissue engineering of pulmonary heart valves on allogenic acellular matrix conduits: in vivo restoration of valve tissue. Circulation 2000; 102 (19 Suppl 3): III50–III55.
19. Tarone G, Galetto G, Prat M, et al. Cell surface molecules and fibronectin-mediated cell adhesion: effect of proteolytic digestion of membrane proteins. J Cell Biol 1982; 94: 179–186.
20. Schenke-Layland K, Vasilevski O, Opitz F, et al. Impact of decellularization of xenogenic tissue on extracellular matrix integrity for tissue engineering of heart valves. J Struct Biol 2003; 143: 201–208.
21. Zhou J, Fritze O, Schleicher M, et al. Impact of heart valve decellularization on 3-D ultrastructure, immunogenicity and thrombogenicity. Biomaterials 2010; 31 (9): 2549–2554.
22. Tudorache I, Cebotari S, Sturz G, et al. Tissue engineering of heart valves: biomechanical and morphological properties of decellularized heart valves. J Heart Valve Dis 2007; 16 (5): 567–573.
23. Bodnar E, Olsen EG, Florio R, et al. Damage of porcine aortic valve tissue caused by the surfactant sodiumdodecylsulphate. Thorac Cardiovasc Surg 1986; 34 (2): 82–85.
24. Weymann A, Loganathan S, Takahashi H, et al. Development and evaluation of a perfusion decellularization porcine heart model – generation of 3-dimensional myocardial neoscaffolds. Circ J 2011; 75 (4): 852–860.
25. Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials 2006; 27 (19): 3675–3683.
26. Taylor DA. From stem cells and cadaveric matrix to engineered organs. Curr Opin Biotechnol 2009; 20 (5): 598–605.
27. Weymann A, Dohmen PM, Grubitzsch H, et al. Clinical experience with expanded use of the Ross procedure: a paradigm shift? J Heart Valve Dis 2010; 19 (3): 279–285.
28. Hodde JP, Record RD, Tullius RS, et al. Retention of endothelial cell adherence to porcine-derived extracellular matrix after disinfection and sterilization. Tissue Eng 2002; 8 (2): 225–234.
29. Bader A, Schilling T, Teebken OE, et al. Tissue engineering of heart valves – human endothelial cell seeding of detergent acellularized porcine valves. Eur J Cardiothorac Surg 1998; 14 (3): 279–284.
30. Segers VF, Lee RT. Stem-cell therapy for cardiac disease. Nature 2008; 451 (7181): 937–942.
31. Abdel-Latif A, Bolli R, Tleyjeh IM, et al. Adult bone marrow-derived cells for cardiac repair: a systematic review and meta-analysis. Arch Intern Med 2007; 167(10): 989–997.
32. Eschenhagen T, Zimmermann WH. Engineering myocardial tissue. Circ Res 2005, 97: 1220–1231.
33. Radisic M, Deen W, Langer R, et al. Mathematical model of oxygen distribution in engineered cardiac tissue with parallel channel array perfused with culture medium containing oxygen carriers. Am J Physiol Heart Circ Physiol 2005; 288: H1278–1289.
34. Sekine H, Shimizu T, Kosaka S, et al. Cardiomyocyte bridging between hearts and bioengineered myocardial tissues with mesenchymal transition of mesothelial cells. J Heart Lung Transplant 2006; 25: 324–332.
35. Furuta A, Miyoshi S, Itabashi Y, et al. Pulsatile cardiac tissue grafts using a novel three-dimensional cell sheet manipulation technique functionally integrates with the host heart, in vivo. Circ Res 2006; 98: 705–712.
36. Miyagawa S, Sawa Y, Sakakida S, et al. Tissue cardiomyoblasty using bioengineered contractile cardiomyocyte sheets to repair damaged myocardium: their integration with recipient myocardium. Transplantation 2005; 80: 1586–1595.
37. Park H, Radisic M, Lim JO, et al. A novel composite scaffold for cardiac tissue engineering. In Vitro Cell Dev Biol Anim 2005; 41: 188–196.
38. Iyer RK, Chiu LL, Reis LA, et al. Engineered cardiad tissues. Curr Opin Biotechnol 2011. Apr. 27. [Epub ahead of print]
Cikk értékelése
| Eddig 1 felhasználó értékelte a cikket. |

Hozzászólások