1Semmelweis Egyetem, Kardiológiai Központ, Budapest, Heidelbergi Egyetem, Szívsebészeti Klinika Kutató Laboratórium, Heidelberg
2Semmelweis Egyetem, Kardiológiai Központ, Budapest
3Heidelbergi Egyetem, Szívsebészeti Klinika Kutató Laboratórium, Heidelberg
4Semmelweis Egyetem, Kardiológiai Központ, Budapest, Heidelbergi Egyetem, Szívsebészeti Klinika Kutató Laboratórium, Heidelberg
5Heidelbergi Egyetem, Szívsebészeti Klinika Kutató Laboratórium, Heidelberg
6Semmelweis Egyetem, Kardiológiai Központ, Budapest
Carotis endarteriectomia által indukált neointimális hiperplázia csökkenthető a szuperoxid-dizmutáz mimetikum kezeléssel patkányokban
2011-12-14Célkitűzés: Reaktív oxigén és nitrogén szabad gyökök (pl. peroxinitrit) elősegíthetik a különböző endovaszkuláris beavatkozásokat követő intimahiperplázia kialakulását, amely resztenózishoz vezet. Patkány carotis endarteriectomia modellben (CEA) vizsgáltuk a szuperoxid-dizmutáz mimetikum mangán(III)-tetrakis(4-benzoesav)-porfirin (MnTBAP) terápiás hatását.
Módszerek: Hím Sprague-Dawley-patkányokban carotis endarteriectomiát végeztünk. Az állatok egy részét MnTBAP-pal kezeltük 15/mg/kg/nap dózisban 3 hétig (CEA3W+MnTBAP-csoport, n=13), a kontrollcsoport kezelést nem kapott (CEA3W, n=15). A carotisokat hagyományos szövettannal, immunhisztokémiával és valós idejű polimeráz láncreakcióval dolgoztuk fel. Lipid-hidroperoxidáz assay-vel mértük a plazmában a malon-dialdehid (MDA) szintet.
Eredmények: Az MnTBAP-kezelés szignifikánsan csökkentette az érszűkületet (10,5±8,1% vs. 45,4±28,3%), a proliferáló sejtmag antigénpozitív sejtek arányát (13,4±7,1% vs. 23,3±11,0%), és a nitrotirozin immunoreaktivitást (5,8±1,9 vs. 8,0±2,0) a kontrollcsoportban észleltekéhez képest. A TUNEL-pozitív sejtmagok aránya szignifikánsan alacsonyabb volt az antioxidáns terápiában részesült csoportban (41,7±26,7% vs. 64,9±18,5%). Az endarteriectomián átesett állatok plazmájában magasabb MDA-szinteket mértünk (11,7±4,8 vs. 4,1±2,0 μmol/l), amely a kezelt csoportban szignifikánsan csökkent (3,2±2,1 μmol/l). Nem találtunk számottevő eltérést génexpressziós szinten az MnTBAP-kezelés hatására.
Következtetés: A szuperoxid-dizmutáz mimetikum MnTBAP-kezeléssel csökkent az endarteriectomia által indukált intima-hiperplázia, amely csökkent simaizomsejt-proliferációval, valamint a nitrooxidatív stressz lokális és szisztémás markereinek csökkenésével társult.
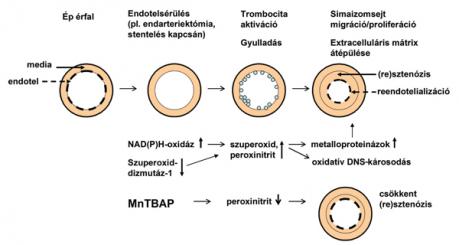
A perkután intervenciós, valamint az érsebészeti eljárások során a rekurrens sztenózis (resztenózis) még napjainkban is az egyik legjelentősebb komplikáció. A resztenózis incidenciája az alkalmazott revaszkularizációs módszertől, a konkrét vaszkuláris területtől (pl. szívkoszorúér, carotis vagy perifériás artériák) és számos egyéb faktortól függően változhat. A hagyományos ballonos koszorúér-angioplasztikát követően a resztenózis gyakorisága akár 30-50% is lehet, amely hagyományos fém stent (10-30%), valamint gyógyszerkibocsátó stent alkalmazásával tovább csökkenthető (1). Az érsérüléseket (pl. endarteriectomia, angioplasztika és stentelés) követően létrejövő resztenózis kialakulásában több, egymást átfedő folyamat játszik szerepet, többek között vérlemezke-aktiváció, gyulladás, vaszkuláris simaizomsejt-migráció és proliferáció, valamint fokozott extracelluláris mátrix-termelés (1, 2). Az utóbbi kettő tehető felelőssé a resztenózishoz vezető neointimális hiperplázia kialakulásáért az érintett erekben. A fent említett folyamatok kiváltásáért felelős legfontosabb tényezők között az endothelium károsodása, és az ennek következtében felszabaduló reaktív oxigén- és nitrogén gyökök (ROS és RNS), például szuperoxid és peroxinitrit képződése említhető (3). A ROS és RNS a resztenózis kialakulásának teljes folyamatában, egyebek mellett a neointima kialakulását eredményező jelátviteli útvonalak aktiválásában, valamint egyes redox-szenzitív gének expressziójának szabályozásában egyaránt szerepet játszanak (4). A ROS létrehozásában elsősorban a vaszkuláris NAD(P)H-oxidázok vesznek részt, míg a ROS eliminálásáért főként a szuperoxid-dizmutáz-1 (SOD-1 vagy CuZnSOD) felelős (3, 5). A ROS képes aktiválni egyes proinflammatórikus gének expresszióját, illetve a szuperoxid-anionok peroxinitrit kialakítása révén képesek fokozni a nitrogén-monoxid (NO) katabolizmusát is (6, 7).
Évek óta ismert a ROS/RNS szintjét csökkentő antioxidáns hatású szerek resztenózis elleni védelemben betöltött szerepe (4, 8, 9). A szabad gyököket megkötő szerek azonban meglehetősen alacsony klinikai hatékonysággal rendelkeznek, elsősorban rövid féléletidejük, valamint limitált szövetpenetrációs képességük miatt. A mangán(III)-tetrakisz(4-benzoesav)-porfirin (MnTBAP) nevű, sejtpermeábilis szuperoxid-dizmutáz-mimetikum és peroxinitrit gyökfogó hatású vegyületről nemrégiben kimutatták, hogy egyes, az oxidatív stresszel kapcsolatba hozható patofiziológiai állapotok során védőhatást fejthet ki (6, 10, 12).
Jelen vizsgálat során célul tűztük ki a neointimális hiperplázia, valamint az oxidatív és nitrózatív stressz lokális, illetve szisztémás jelei közötti kapcsolat vizsgálatát vaszkuláris sérülés során az általunk alkalmazott patkány carotis endarteriektómiás modellben. Továbbá vizsgálni kívántuk az antioxidáns MnTBAP hatásait a neointimális hiperpláziában, valamint a génexpresszió szabályozásában (13).
Módszerek
Carotis endarteriectomia patkányban
Harminckét, altatott (100 mg/kg ketamin-hidroklorid és 3 mg/kg xilazin-hidroklorid) hím Sprague-Dawley patkányon végeztünk jobb oldali carotis communis endarteriectomiát, a korábban ismertetett módszer szerint (14). A nyaki izmok feltárása, és a carotis kipreparálása után az eret egy-egy proximális és disztális klippel kirekesztettük a keringésből, majd longitudinális arteriotomiát végeztünk 6 mm hosszan. Az endothel-eltávolítást 0,1%-os szaponin oldatba mártott vattapálcával végeztük. Az eret tovafutó 9/0-ás fonallal zártuk, ügyelve az eredeti lumennagyság megtartására. Vérzéscsillapítás után zártuk az izom- és bőrrétegeket.
Kísérleti csoportok
Az állatokat a következő 3 csoportba randomizáltuk: carotis endarteriectomia kezelés nélkül, 1 órás (CEA1h, n=4) és 3 hetes utánkövetéssel (CEA3w, n=15), valamint carotis endarteriectomia 3 hetes MnTBAP-kezeléssel 15 mg/kg/nap dózisban (CEA3w+MnTBAP, n=13). Az MnTBAP alkalmazott dózisát korábbi releváns közleményekre alapoztuk (10). A carotisok 4 csoportját dolgoztuk fel: a kezeletlen, endarteriectomizált patkányok bal oldali carotisát (sham), a kezeletlen endarteriectomizált patkányok jobb oldali carotisát 1 órával (CEA1h) és 3 héttel (CEA3w) a műtét után, valamint az MnTBAP-pal kezelt endarteriectomizált patkányok jobb oldali carotisát (CEA3w+ MnTBAP).
Szövettan, immunhisztokémia, TUNEL
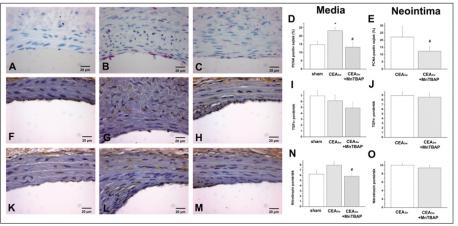
A sham (n=10), a CEA3w (n=10) és a CEA3w+ MnTBAP (n=9) csoportokban hematoxilin-eozin festett metszeteken morfometriai kiértékelést végeztünk. Digitalizált mikroszkópos képeken a lamina elastica externa és interna azonosítása után mértük a lumen, neointima, media és adventitia területét, ezekből különböző paramétereket származtattunk (neointima/ media területarány, sztenózis %-os értéke). Proliferáló sejtmag-antigén (PCNA), transzformáló növekedési faktor ß1 (TGFß1) és nitrotirozin (NT) elleni antitestekkel immunhisztokémiai festéseket készítettünk, melyeket szemikvantitatív módon pontrendszer alapján értékeltünk ki. TUNEL (terminális deoxinukleotidil-transzferáz mediálta 2'deoxiuridin, 5'trifoszfát-biotin végjelzés) assay-vel a DNS-károsodás mértékét, illetve apoptózis jelenlétét vizsgáltuk a neointima sejtjeiben.
Reverz transzkripció és kvantitatív valós idejű polimeráz láncreakció (RT-qPCR)
A sham (n=5), CEA1h (n=4), CEA3w (n=5) és a CEA3w+MnTBAP (n=4) csoportok carotis artériáit folyékony nitrogénben homogenizáltuk majd RNS-t izoláltunk a mintákból. Csoportonként 1,4 µg RNS reverz transzkripciója után qPCR-t végezünk a gyulladásban, proliferációban és extracelluláris mátrix átépülésben szerepet játszó gének expressziójának vizsgálatára.
Lipid-hidro-peroxidáz assay
Alvadásgátolt vénás vérmintákat gyűjtöttünk a CEA3w (n=15) és a CEA3w+MnTBAP (n=13) csoport állatainak feldolgozásakor, illetve további öt, beavatkozáson át nem esett állatból (sham, n=5). A plazma elválasztása után –80 °C-on tároltuk a mintákat a mérésig, amelynek során lipid-hidro-peroxidáz kittel határoztuk meg a malon-dialdehid (MDA) koncentrációját.
Statisztikai analízis
Az eredményeket átlag±szórás formájában mutatjuk be, a kísérleti csoportok statisztikai összehasonlítását az Origin 7 programmal végeztük. Két csoport esetén kétmintás Student-féle t-próbát, több csoport esetén ANOVA módszerét alkalmaztuk. Szignifikánsnak tekintettük a p<0,05 értékeket.
Eredmények
MnTBAP-kezelés csökkenti a neointimális hiperpláziát
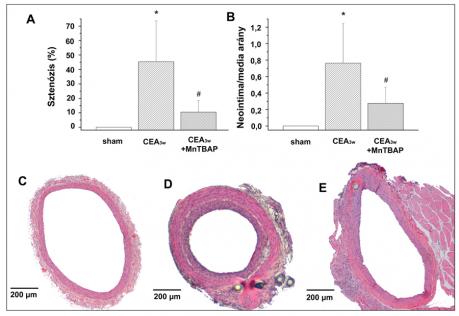
Három héttel az endarteriectomia után átlag 45,41%-os szűkületet okozó neointimális hiperpláziát figyeltünk meg az erekben (1. ábra). Az MnTBAP-pal kezelt csoportban a sztenózis szignifikánsan alacsonyabb volt (10,48%). Az egyes csoportokba tartozó erek teljes keresztmetszeti területe, illetve a média területe nem különbözött. A másik fontos morfometriai paraméterben, a neointima/media területarányban is szignifikáns csökkenést észleltünk (0,27 a CEA3w+MnTBAP-csoportban vs. 0,76 a CEA3w-csoportban). A sham csoportban normál érstruktúrát figyelhettük meg ép endothelréteggel (1. ábra).
Csökkent sejtosztódási arány és nitrooxidatív stressz MnTBAP-kezelés hatására
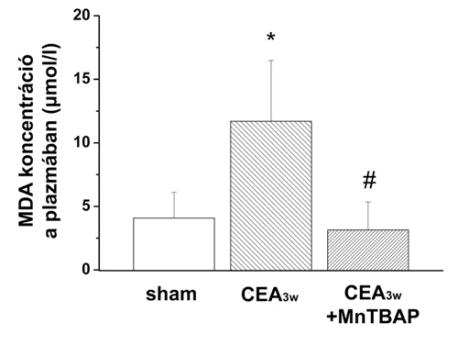
A sham csoporttal összevetve a CEA3w-csoport médiájában szignifikánsan nagyobb volt a sejtosztódás aránya. Mind a neointima, mind a média rétegében jelentősen csökkent az osztódó sejtek száma az MnTBAP-pal kezelt csoportban a CEA3w-csoporthoz képest (2. ábra). Ugyanakkor a TGFß1 immunoreaktivitásban nem láttunk különbséget az egyes csoportok között. A CEA3w-csoport mediarétegében tendenciájában fokozott nitrózatív stressz figyelhető meg. A CEA3w+ MnTBAP-csoportban észlelt csökkent nitrotirozin immunoreaktivitás kevesebb peroxinitrit jelenlétére utal. A nem specifikus TUNEL-festést az oxidatív DNS-károsodás markereként használtuk. A CEA3w-csoportban a shamhez képest észelt mintegy hatszoros TUNEL-pozitivitás egyértelműen jelzi a média simaizomsejtjeinek endarteriectomiával kapcsolatos oxidatív károsodását, amelyet az MnTBAP-kezelés kivédett, ugyanakkor a csökkenés csak a médiában volt szignifikáns, a neointimális rétegben önmagában nem (3. ábra). Lipid-hidro-peroxidáz assay is az oxidatív károsodás csökkenését igazolta az MnTBAP-pal kezelt csoportban, amely a plazma MDA-szint 2,86-szoros emelkedését szignifikánsan csökkentette (4,09±2,03 µmol/l a sham csoportban; 11,70±4,77 µmol/l a CEA3w-csoportban; 3,15±2,19 µmol/l a CEA3w+MnTBAP-csoportban) (4. ábra).
MnTBAP-kezelés nincs számottevő hatással a génexpresszióra
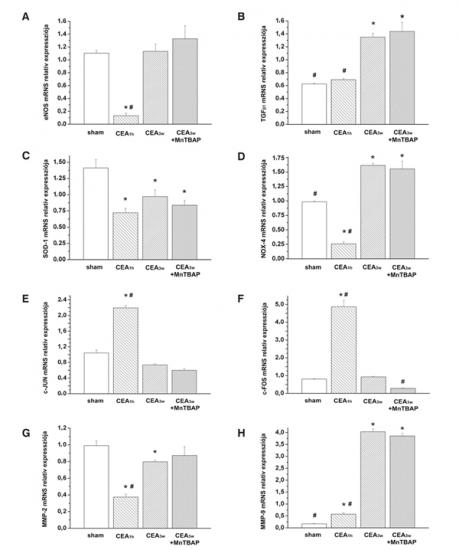
Carotis endarteriectomia után 1 órával tizedére csökkent az endotheliális nitrogén-oxid-szintáz (eNOS) expressziója, amely az effektív endothel-eltávolítással korrelál (5. ábra). A CEA3w-csoportban ismét a kiindulási eNOS-szintet látjuk, amely reendothelializációt igazol. A TGFß1 expressziója akutan nem, csak 3 héttel az endarteriectomia után emelkedett, a CEA3w+ MnTBAP-csoportban azonban változatlan maradt. A NAD(P)H-oxidáz 4 szintje emelkedett volt, míg a szuperoxid-dizmutáz expressziója csökkent három héttel az endarteriectomia után, jelezvén az oxidatív stresszt. A kezelés hatására nem következett be változás ezen gének expressziójában sem. A protoonkogén c-JUN és c-FOS expressziója emelkedett 1 órával a műtét után, majd 3 hétnél a sham csoport szintjére tért vissza. A mátrix-metalloproteináz-2 (MMP-2) mind 1 órával, mind 3 héttel a műtét után downregulálódott, míg az MMP-9 mindkét időpontban upregulálódott. Az MnTBAP-kezelés ezen gének esetében sem okozott expresszió-változást (5. ábra).
Megbeszélés
Számos korábban megjelent tanulmány bizonyítja, hogy a reaktív oxigén- és nitrogén gyökök fontos szerepet játszanak a neointima kialakulásában, ami végső soron resztenózishoz vezet (4, 8, 15). Ugyanakkor meglehetősen kevés vizsgálatban értékelték az antioxidáns szerek terápiás szerepét a resztenózis csökkentésére in vivo modellekben. Saját kísérleti modellünkben a neointimális hiperplázia indukcióját a hagyományosan alkalmazott eljárás (az endothelium eltávolítása) mellett sebészi arteriotomiával egészítettük ki. Kísérleteink során igazoltuk, hogy a carotis endarteriectomia a vaszkuláris simaizomsejtek fokozott proliferációját és fokozott nitrooxidatív stresszt vált ki. A szuperoxid-dizmutáz mimetikum és peroxinitrit gyökfogó MnTBAP csökkentette a neointima képződését és a nitrooxidatív stressz mértékét, valamint a simaizomsejtek proliferációs aktivitását. A carotis endarteriectomiát követő harmadik hétre mintegy 50%-os érszűkület alakult ki a növekvő neointima következtében. A kezelt csoportban a neointima/media arány 3-szoros csökkenését sikerült megfigyelnünk. Korábbi eredményeink alapján az NO és szuperoxid-anionok peroxinitrit kialakulását eredményezik, amely végső soron csökkenti a biológiai szempontból hozzáférhető NO mennyiségét. Az endothelium károsodása a csökkent eNOS-aktivitás által ugyancsak csökkent NO-termeléshez vezet (8, 16). Az NO-cGMP jelátviteli útvonal csökkent aktivitása szerepet játszik a neointima kialakulásában, az ezen útvonalat aktiváló ágensek pedig enyhítik a folyamat előrehaladtát (14, 17). Ez a mechanizmus azonban egyelőre nincs teljes mértékben felderítve; feltételezések szerint a csökkent mértékű sejtmigráció/proliferáció mediálja az aktivált NO-cGMP-jelátvitel kedvező hatásait. Másrészt viszont a peroxinitrit – amely inkább hetekkel a sérülést követően termelődik, amikor az NO-leadás feltételezhetően a regenerálódó endothelium felől történik – a sejtosztódásért felelős jelátviteli útvonalak működését serkenti (18–20). Eredményeink alapján az endarteriectomia-indukált peroxinitrit-képződést az MnTBAP hatékonyan volt képes csökkenteni, amely csökkent mértékű sztenózis kialakulását eredményezte az endothelium sérülését követő harmadik hétre (6. ábra). A peroxinitrit közvetlenül képes károsítani a lipideket, a fehérjéket és a DNS-t, és képes aktiválni a mátrix-metalloproteinázokat (21, 22). Zhang és munkatársai közleményükben feltételezték az oxidatív DNS-károsodás patofiziológiai szerepét a neointima kialakulása során (23). Saját vizsgálataink során 3 héttel az endarteriectomia után a TUNEL-pozitív sejtszám igen nagymértékű emelkedését figyeltük meg a mediában a sham csoporthoz képest, amely szignifikáns mértékben alacsonyabbnak bizonyult a CEA3w+MnTBAP-csoportban. Ugyanilyen tendenciát figyeltünk meg a neointimális rétegben is. A lipid-peroxidáció mértékét a malon-dialdehid – a többszörösen telítetlen zsírsav-hidro-peroxidok bomlásterméke – mennyiségének mérésével határoztuk meg a vérplazmában (24). Mivel ezen marker szintje a CEA3w-csoportban mintegy háromszor magasabb volt a sham csoporthoz képest, feltételezhetjük, hogy a lokálisan termelődött ROS/RNS reagált a plazmalipidekkel, ami a megemelkedett MDA-plazmaszintet eredményezte. Az MnTBAP-vegyülettel történt kezelést követően az MDA a sham csoportban megfigyelt alacsony szintre csökkent, ami a nitrooxidatív ágensek hatékony eliminálására enged következtetni. Érdekes módon, míg az MnTBAP-kezelést követően tapasztalt alacsonyabb proliferációs ráta, valamint a csökkent oxidatív és nitrózatív stressz (immunohisztokémiai módszerrel történő detektálás alapján) a károsodott carotisok mediájában jelentős mértékben szignifikánsnak bizonyult, addig a neointimális rétegben csupán tendenciákat tudtunk megfigyelni, ahol a CEA3w és a CEA3w+ MnTBAP-csoportok közötti különbségek alacsonyabbak voltak. Fenti eredményeink arra utalhatnak, hogy a nitrooxidatív stimulusok, illetve az antioxidás kezelés eltérő mértékben érintik a károsodott artériák médiáját és neointimáját, vagy eltérő útvonalakon keresztül fejtik ki hatásaikat; ezt a feltételezést egyébként már több más munkacsoport is felvetette (9). Eredményeink alapján az antioxidáns MnTBAP nem befolyásolta a génexpressziós mintázatot, ami arra utalhat, hogy a szer poszttranszlációs hatással bír, mégpedig elsősorban a nitrózatív és oxidatív ágensek csökkent szintjének következtében (csökkent NT-immunoreaktivitás, oxidatív DNS-károsodás, illetve alacsonyabb mértékű lipid-peroxidáció). A fentiek ellenére az RT-qPCR-analízisek több érdekes eredménnyel is szolgáltak. Az egy órával az endarteriectomia után csökkent eNOS-expresszió a műtét során sikeres endothel-eltávolításra utal. A műtétet követő harmadik hétre azonban az eNOS expressziós szintje újra elérte a sham csoportra jellemző szintet, ami a reendothelializáció létrejöttét igazolja. Egyes növekedési faktorok, például a TGFß1 fontos szereppel bírnak a proliferálódó szövetekben, mint például a neointimában, amit saját kísérleteinkben nekünk is sikerült megfigyelnünk: az operációt követő harmadik hétre a TGFß1-gén expressziójának mértéke kétszeresére emelkedett (25). A vaszkuláris NAD(P)H-oxidáz-4 expressziójának 1,6-szoros emelkedését detektáltuk; az érfal sérülését követően elsősorban ez a molekula tehető felelőssé a szuperoxid termeléséért. Korábbi vizsgálatok eredményei alapján a szuperoxid képes serkenteni a sejtproliferációs rátát (15, 26, 27). A SOD-1 – a szuperoxid eliminálásáért elsődlegesen felelős enzim az érfalban – expressziója ugyanakkor csökkenést mutatott a CEA3w-csoportban a sham csoportéhoz képest (28).
A fölösleges mennyiségben termelődött szuperoxid-anionok kölcsönhatásba lépnek a nitrogén-oxiddal, és peroxinitrit jön létre. A fentieken túl az endarteriectomiát követő első óra után a c-Jun és c-Fos protoonkogének gyors expresszió fokozódását is kimutattuk a carotisokban. Az irodalomból is jól ismert, hogy a protoonkogének aktiválódása szerepet játszik a neointima kialakulásának legkorábbi stádiumában, majd ezt követően expressziójuk szintje a resztenózis kialakulásának további lépései során visszatér az alapvonalra (29, 30). Saját kísérleteink során is azt találtuk, hogy a c-Jun és a c-Fos expressziója a CEA3w-csoportban gyakorlatilag azonos volt a sham csoportban detektálható értékekkel. A mátrix-metalloproteinázok az extracelluláris mátrix komponenseinek lebontása révén rendkívül fontos szerepet játszanak a neointima kialakulása során, hiszen a vaszkuláris simaizomsejtek ennek révén könnyedén átvándorolhatnak a belső elasztikus membránon. Webb és munkatársai eredményeivel összhangban mi is azt találtuk, hogy az MMP-2 konstitutívan expresszálódik a normál, kezeletlen (sham) artériákban; szintje csökken a korai posztoperatív időszakban (1 óra), ezt követően pedig expressziója emelkedik (31). Az MMP-9 expressziója a sham csoport artériáiban alig volt kimutatható; a sérülést követő első órában szintje megemelkedett, és a három hetes vizsgálati periódus során mindvégig erősen emelkedett expressziót mutatott.
Következetések
Kísérleteink során új eredményekkel járultunk hozzá a neointimalis hiperplázia kialakulásának antioxidáns terápia alkalmazásával történő gátlásához a patkány carotis endarteriectomia modell segítségével. A szuperoxid-dizmutáz-mimetikum és peroxinitrit gyökfogó tulajdonságokkal rendelkező MnTBAP a vaszkuláris simaizomsejtek osztódásának, valamint a nitrooxidatív stressz hatásainak csökkentése révén csökkentette a sztenózis kialakulását.
2. Rajagopal V, Rockson SG. Coronary restenosis: A review of mechanisms and management. Am J Med 2003; 115: 547–553.
3. Griendling KK, Sorescu D, Lassegue B, et al. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol 2000; 20: 2175–2183.
4. Azevedo LC, Pedro MA, Souza LC, et al. Oxidative stress as a signaling mechanism of the vascular response to injury: The redox hypothesis of restenosis. Cardiovasc Res 2000; 47: 436–445.
5. Dourron HM, Jacobson GM, Park JL, et al. Perivascular gene transfer of nadph oxidase inhibitor suppresses angioplasty-induced neointimal proliferation of rat carotid artery. Am J Physiol Heart Circ Physiol 2005; 288: H946–953.
6. Levrand S, Vannay-Bouchiche C, Pesse B, et al. Peroxynitrite is a major trigger of cardiomyocyte apoptosis in vitro and in vivo. Free Radic Biol Med 2006; 41: 886–895.
7. Mollace V, Ragusa S, Sacco I, et al. The protective effect of bergamot oil extract on lecitine-like oxyldl receptor-1 expression in balloon injury-related neointima formation. J Cardiovasc Pharmacol Ther 2008; 13: 120–129.
8. Beller CJ, Radovits T, Kosse J, et al. Activation of the peroxynitrite-poly(adenosine diphosphate-ribose) polymerase pathway during neointima proliferation: A new target to prevent restenosis after endarterectomy. J Vasc Surg 2006; 43: 824–830.
9. Kanellakis P, Pomilio G, Walker C, et al. A novel antioxidant 3,7-dihydroxy-isoflav-3-ene (dhif) inhibits neointimal hyperplasia after vessel injury attenuating reactive oxygen species and nuclear factor-kappab signaling. Atherosclerosis 2009; 204: 66–72.
10. Adeagbo AS, Zhang X, Patel D, et al. Cyclo-oxygenase-2, endothelium and aortic reactivity during deoxycorticosterone acetate salt-induced hypertension. J Hypertens 2005; 23: 1025–1036.
11. Kastenbauer S, Koedel U, Becker BF, et al. Pneumococcal meningitis in the rat: Evaluation of peroxynitrite scavengers for adjunctive therapy. Eur J Pharmacol 2002; 449: 177–181.
12. Szabo C, Day BJ, Salzman AL. Evaluation of the relative contribution of nitric oxide and peroxynitrite to the suppression of mitochondrial respiration in immunostimulated macrophages using a manganese mesoporphyrin superoxide dismutase mimetic and peroxynitrite scavenger. FEBS Lett 1996; 381: 82–86.
13. Hirschberg K, Radovits T, Korkmaz S, et al. Combined superoxide dismutase mimetic and peroxynitrite scavenger protects against neointima formation after endarterectomy in association with decreased proliferation and nitro-oxidative stress. Eur J Vasc Endovasc Surg 2010; 40: 168–175.
14. Hirschberg K, Radovits T, Loganathan S, et al. Selective phosphodiesterase-5 inhibition reduces neointimal hyperplasia in rat carotid arteries after surgical endarterectomy. J Thorac Cardiovasc Surg 2009; 137: 1508–1514.
15. Szocs K, Lassegue B, Sorescu D, et al. Upregulation of nox-based nad(p)h oxidases in restenosis after carotid injury. Arterioscler Thromb Vasc Biol 2002; 22: 21–27.
16. Dusting GJ, Fennessy P, Yin ZL, et al. Nitric oxide in atherosclerosis: Vascular protector or villain? Clin Exp Pharmacol Physiol 1998; 25 (Suppl): S34–41.
17. Melichar VO, Behr-Roussel D, Zabel U, et al. Reduced cgmp signaling associated with neointimal proliferation and vascular dysfunction in late-stage atherosclerosis. Proc Natl Acad Sci U S A 2004; 101: 16671–16676.
18. Bapat S, Verkleij A, Post JA. Peroxynitrite activates mitogen-activated protein kinase (mapk) via a mek-independent pathway: A role for protein kinase c. FEBS Lett 2001; 499: 21–26.
19. Kennedy S, Preston AA, McPhaden AR, et al. Correlation of changes in nitric oxide synthase, superoxide dismutase and nitrotyrosine with endothelial regeneration and neointimal hyperplasia in the balloon-injured rabbit subclavian artery. Coron Artery Dis 2004; 15: 337–346.
20. Minetti M, Mallozzi C, Di Stasi AM. Peroxynitrite activates kinases of the src family and upregulates tyrosine phosphorylation signaling. Free Radic Biol Med 2002; 33: 744–754.
21. Pacher P, Schulz R, Liaudet L, et al. Nitrosative stress and pharmacological modulation of heart failure. Trends Pharmacol Sci 2005; 26: 302–310.
22. Wang W, Sawicki G, Schulz R. Peroxynitrite-induced myocardial injury is mediated through matrix metalloproteinase-2. Cardiovasc Res 2002; 53: 165–174.
23. Zhang C, Yang J, Jennings LK. Attenuation of neointima formation through the inhibition of DNA repair enzyme parp-1 in balloon-injured rat carotid artery. Am J Physiol Heart Circ Physiol 2004; 287: H659–666.
24. Janero DR. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury. Free Radic Biol Med 1990; 9: 515–540.
25. Wolf YG, Rasmussen LM, Ruoslahti E. Antibodies against transforming growth factor-beta 1 suppress intimal hyperplasia in a rat model. J Clin Invest 1994; 93: 1172–1178.
26. Laukkanen MO, Kivela A, Rissanen T, et al. Adenovirus-mediated extracellular superoxide dismutase gene therapy reduces neointima formation in balloon-denuded rabbit aorta. Circulation 2002; 106: 1999–2003.
27. Li PF, Dietz R, von Harsdorf R. Differential effect of hydrogen peroxide and superoxide anion on apoptosis and proliferation of vascular smooth muscle cells. Circulation 1997; 96: 3602–3609.
28. Stralin P, Karlsson K, Johansson BO, et al. The interstitium of the human arterial wall contains very large amounts of extracellular superoxide dismutase. Arterioscler Thromb Vasc Biol 1995; 15: 2032–2036.
29. Muller DW. The role of proto-oncogenes in coronary restenosis. Prog Cardiovasc Dis 1997; 40: 117–128.
30. Watson L, Herdegen T, Buschmann T, et al. Jnk and c-jun but not erk and c-fos are associated with sustained neointima-formation after balloon injury. Eur J Clin Invest 2000; 30: 11–17.
31. Webb KE, Henney AM, Anglin S, et al. Expression of matrix metalloproteinases and their inhibitor timp-1 in the rat carotid artery after balloon injury. Arterioscler Thromb Vasc Biol 1997; 17: 1837–1844.
Cikk értékelése
| Eddig 2 felhasználó értékelte a cikket. |

Hozzászólások